FDA, çarşamba günü meme implantı ambalajına uyarılar koydu ve üreticilere, cihazlarını yalnızca ameliyattan önce hastalarla ilgili potansiyel riskleri gözden geçiren sağlık sağlayıcılarına satmalarını söyledi.
Hem uyarılar hem de hastalara riskler ve yan etkiler konusunda tavsiyede bulunan yeni bir kontrol listesi; meme implantlarının bir bağışıklık sistemi kanseriyle ve otoimmün hastalıklar, eklem ağrısı, zihinsel karışıklık dahil olmak üzere bir dizi başka kronik tıbbi durumla bağlantılı olduğunu belirtiyor.
Kontrol listesi; meme implantı ameliyatından sonra hastalık açısından daha yüksek risk altında olan belirli hastalık türlerini tanımlıyor. Risk grubu, kemoterapi veya radyasyon tedavisi görmüş veya yaptırmayı planlayan meme kanseri hastalarını içeriyor. Bu, şimdiye kadar tedavilerini takiben implantlarla meme rekonstrüksiyonu yaptırmaya teşvik edilen kadınların büyük bir yüzdesini temsil ediyor.
UYGULAMA İLE İLGİLİ ENDİŞELER VAR
Gıda ve İlaç İdaresi, üreticilerin meme implantlarını yapmak için kullanılan bileşenlerin açıklamasını da istiyor.
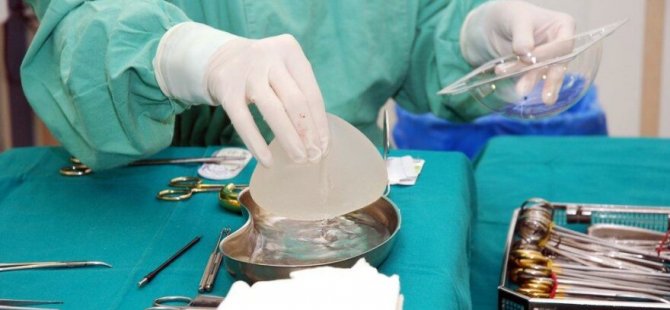
Yeni önlemlerin nasıl uygulanacağı henüz çok açık değil ve hastaların genellikle yalnızca bir cerrah tarafından kullanılan paketlenmiş steril tıbbi cihazın üzerinde bir uyarı etiketi görmeleri pek olası değil.
Ajansın yeni uyarıları yıllardır yapılıyor. On yıl önce, FDA dokulu bir yüzeye sahip meme implantları ile lenfoma arasında olası bir bağlantı tanımladı.

2019’un başlarında, yıllarca implantlarla bağlantılı yüz binlerce olumsuz yan etki raporu aldıktan sonra, ajans düzinelerce kadından kanserle mücadeleleri ve implant ameliyatından sonra gelişen diğer tıbbi sorunlar hakkında verdikleri bilgileri gözden geçirdi.
Yeni gereksinimlere tepkiler karışıktı: Bazı doktorlar yeni uyarı sistemini memnuniyetle karşılarken, diğerleri potansiyel risklerin hastalara yeterince iletilmeyeceğinden ve yeni kontrol listesinin küçümseyen bir şekilde ele alınacağından endişelendi.
GELECEK İÇİN BÜYÜK BİR ADIM
Eleştirmenler ayrıca kontrol listesinin aşırı uzun olduğunu ve geniş bir dilde yazıldığını söyledi. Ulusal Sağlık Araştırmaları Merkezi başkanı ve FDA’ya danışmanlık yapan çalışma grubunun üyesi olan Diana Zuckerman, “Hiç yoktan iyidir, ancak olabileceği kadar iyi değil” dedi. Dr. Zuckerman sözlerine şu şekilde devam etti:
“Ya bir cerrah, ‘İşte bir kontrol listesi; uzun olduğunu biliyorum, bu yüzden okumak isteyip istemediğiniz size kalmış’ derse? Hasta grupları bunun olacağı konusunda çok endişeli.”
Ancak, Houston’daki M.D. Anderson Kanser Merkezi’nde profesör olan ve FDA ile irtibat halinde olan Dr. Mark Clemens, Amerikan Plastik Cerrahlar Derneği için, kara kutu uyarısı ve kontrol listesinin hasta güvenliği ve implantlar için ileriye doğru büyük bir adım olduğunu söyledi. Ancak implantlı kadınlar için uzun vadeli sonuçları hakkında daha yüksek kaliteli verilere ihtiyaç olduğunu da sözlerine ekledi.
Amerika Birleşik Devletleri’nde her yıl yaklaşık 400.000 kadın meme implantı alıyor; 300.000’i kozmetik nedenlerle ve 100.000’i meme kanserini tedavi etmek veya önlemek için yapılan mastektomilerden sonra rekonstrüksiyon için.






























































Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.